Projets de Recherche
Porteur Michèle Bastide
Description du projet
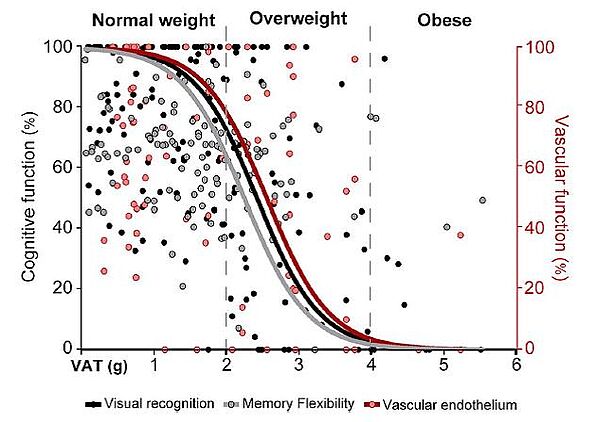
La présence de troubles métaboliques à un âge moyen est associée à un risqué élevé de survenue de troubles cognitifs à un âge avancé. Afin de comprendre les mécanismes physiopathologiques qui prédisposent le tissu cérébral à un dysfonctionnement cognitif, nous avons développé un modèle murin à long terme qui reproduit la mise en place progressive de troubles métaboliques en réponse à une alimentation riche en gras. Ce modèle a permis la mise en évidence d’un dysfonctionnement cérébrovasculaire associé à mise en place de troubles métaboliques (adiposité viscérale et prédiabète) et d’un déficit cognitif. Grâce à l’association de techniques d’évaluation comportementale, d’exploration cérébrovasculaire, d’électrophysiologie et de caractérisation métabolique, ce projet se poursuit selon 2 axes, (i) l’étude des mécanismes impliqués dans le découplage neurogliovasculaire ; (ii) l’impact de la modulation pharmacologique ou nutraceutique des troubles métaboliques sur le déficit cognitif.
Composition de l'équipe: Michèle Bastide, Olivier Petrault, Maud Petrault, Sandra Mouchref, Thavarak Ouk, Stéphanie Bombois, Vincent Berezowski, Patrick Gelé, Manon Haas.
Faits marquants
- Mise en évidence de la relation entre adiposité viscérale, dysfonction cérébrovasculaire et survenue de troubles cognitifs en milieu de vie sur un modèle murin induit par l’alimentation (High-fat diet)
- Modulations pharmacologiques et/ou nutraceutiques des troubles métaboliques : impact sur les troubles cognitifs
- Développement d’un modèle murin à long terme de troubles métaboliques induits par l’alimentation (High-fat diet)
Publications
Pétrault, O., Pétrault, M., Ouk, T., Bordet, R., Bérézowski, V., Bastide, M., 2019. Visceral adiposity links cerebrovascular dysfunction to cognitive impairment in middle-aged mice. Dis. 130, 104536.
Pétrault, M., Ouk, T., Bastide, M., Bordet, R., Pétrault, O., Bérézowski, V., 2021. Age and diet modify acute microhemorrhage outcome in the mouse brain. Neurobiol Aging 98, 107.
Porteur Caroline Moreau
Description du projet
GAIT’N PARK: Analyse prospective des troubles de la marche dans les syndroms parkinsoniens avec semelles connectées (2020 en cours)
IPARK: semelles connectées pour la rééducation de la marche et la prévention des chutes en DP (2020 en cours)
La démarche est un biomarqueur crucial dans le parkinsonisme car elle est progressivement et inexorablement affectée dans tous les cas, avec des composants différents et des parcours temporels différents. Cependant, l'évolution temporelle de l'occurrence, la phénoménologie spécifique et le handicap fonctionnel peuvent être très hétérogènes au sein de la population. L'évaluation non supervisée des technologies de la mobilité apparaît comme essentielle pour l'évaluation à long terme de la mobilité et la prise de décision clinique personnalisée en neurologie car elle reflète la vie quotidienne des patients qui est visée par tout type d'intervention thérapeutique.
Un large panel de paramètres de marche communs peut être évalué pendant une longue fenêtre de temps, pendant la démarche, les transitions posturales ou les virages: longueur du pas, vitesse, cadence, accélération de la marche, temps de posture, temps de pas, temps de swing, durée de position debout la durée de la position assise à la position debout, la vitesse angulaire de virage moyenne et bien d'autres qui peuvent être déduites des paramètres de base.
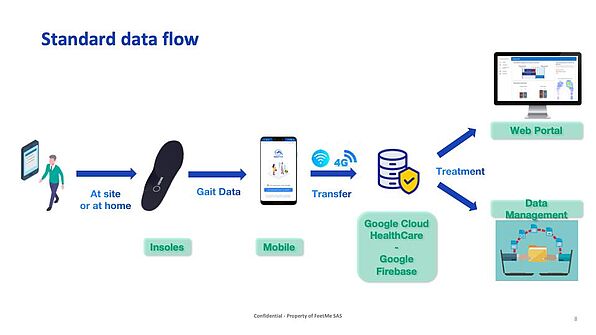
Le développement d'appareils connectés comme les appareils FeetMe® ou PKG Monitor semelles apporte des données très précieuses aux cliniciens, qui peuvent mieux comprendre la mobilité des patients (nombre de pas par jour), l'activité (symptômes non moteurs comme l'apathie) et même la survenue d'événements paroxystiques ( nombre de FoG, chutes, chutes proches…).
Composition de l'équipe: Caroline Moreau (MD PhD HDR), David Devos (MD, PhD, HDR), Luc Defebvre (MD, PhD, HDR), Guillaume Grolez (MD, PhD), Thomas Ollivier MD
DRI CHU Lille : Pauline Guyon-Delannoy (project manager), Edouard Millois, Marie Pleuvret
Collaborations internationales:
Prof Alice nieuwboer, Professeur Faculté des sciences du mouvement et de la réadaptation KULeuven; Belgique.
Prof Bas Bloem, neurologue et chercheur à Radboudumc. En 2002, il a créé le Parkinson Centrum, Nimègue, Pays-Bas.
Dr Anat Mirelman, PhD, professeur agrégé, École de médecine Sackler et École de neurosciences Sagol de l'Université d'Aviv; Directeur du laboratoire des marqueurs précoces de la neurodégénérescence au centre médical de Tel Aviv; Tel Aviv, Israël.
Dr Serge Pinto, PhD, directeur de recherche, CNRS laboratoire parole et langue, Aix en Provence, France.
Dr Anahita Basirat, PhD, Laboratoire SCALab UMR CNRS 9193 Lille, France.
Collaborations industrielles:
Feet Me, Lundbeck
Labels/ financements:
- 2012 Association France Parkinson: « PRO-DY-GI Park » Prospective study on Dysarthria and non-dopaminergic symptoms in PD
- 2012 CHU de Lille « TEP FOG »
- 2014 Université de Lille Scientific Excellence Prize of the Lille University
- 2016 Association France Parkinson / association Vaincre Parkinson : « PRO-DY-GI Park II » Prospective study on Dysarthria and non-dopaminergic symptoms in PD follow up & multimodal MRI study IRM
- 2017 Prize of University Foundation for the Innovative Therapeutic Strategy of DIVE (Dopamine with intracerebroventricular administration) https://www.univ-lille.fr/universite/fondation-universite-de-lille/inbrain-pharma
- 2018 Prize I-LAB: French National concours to help the creation of start up for innovative technologies: the start-up InBrain Pharma http://www.inbrainpharma.com
- 2019 Association France Parkinson/Association Vaincre Parkinson/ Lundbeck et Feet Me : projet « Gait N Park »
- 2020 Prize Defi Santé CHU Lille and Eurasanté for IPARK (connected insoles for gait rehabilitation and fall prevention in PD)
Faits marquants
PARKGAIT-II: étude multicentrique du méthylphénidate pour traiter les troubles de la marche et le déficit d'attention dans la maladie de Parkinson. ID de protocole: 2008-005801-20; ClinicalTrials.gov: NCT00914095
TEP-FOG: Une analyse TEP en temps réel pour le gel de la marche en DP (2010-A01329-30) FOGG-I: étude monocentrique de la mémantine pour les troubles de la marche et le déficit d'attention dans la maladie de Parkinson ID de protocole: 2008-008210-38; ClinicalTrials.gov: NCT01108029
PRODYGI-1: Étude prospective sur la dysarthrie et autres symptômes axiaux non dopaminergiques dans la MP (2012-A01544-47)
PREDISTIM: Etude multicentrique des facteurs prédictifs de la réponse thérapeutique à la stimulation subthalamique sur la qualité de vie à long terme et étude des facteurs pharmacogénétiques de la réponse au traitement par L-dopa dans la maladie de Parkinson Protocol ID: 2013-A00193-42; ClinicalTrials.gov: NCT02360683
PRODYGI-2: Etude prospective sur la dysarthrie et autres symptômes axiaux non dopaminergiques dans la MP, approche multimodale (2016-A01544-47)
DIVE: Évaluation de l'innocuité et de l'efficacité de la stimulation dopaminergique continue par administration intracérébroventriculaire de dopamine anaérobie conservée dans la maladie de Parkinson au stade de la fluctuation motrice. ID de protocole: 2018_49
Publications
Moreau C, Pinto S. Misconceptions about speech impairment in Parkinson's disease. Mov Disord. 2019 Oct;34(10):1471-1475. doi: 10.1002/mds.27791. Epub 2019 Jul 15. PMID: 31307114.
D'Cruz N, Vervoort G, Fieuws S, Moreau C, Vandenberghe W, Nieuwboer A. Repetitive Motor Control Deficits Most Consistent Predictors of Conversion to Freezing of Gait in Parkinson's Disease: A Prospective Cohort Study. J Parkinsons Dis. 2020;10(2):559-571. doi: 10.3233/JPD-191759. PMID: 32039860.
Moreau C, Devos D, Baille G, Delval A, Tard C, Perez T, Danel-Buhl N, Seguy D, Labreuche J, Duhamel A, Delliaux M, Dujardin K, Defebvre L. Are Upper-Body Axial Symptoms a Feature of Early Parkinson's Disease? PLoS One. 2016 Sep 21;11(9):e0162904. doi: 10.1371/journal.pone.0162904. PMID: 27654040; PMCID: PMC5031440.
Porteur Renaud Lopes
Description du projet
L’imagerie médicale est un outil de choix dans la compréhension des mécanismes cérébraux sous-jacents à l’apparition et l’évolution des troubles cognitifs dans les maladies neurologiques. Nous avons développé des marqueurs transversaux utilisant des données IRM et TEP, par des approches géométriquement optimisées à l’analyse du cortex, d’analyse des connectivités cérébrales et de quantification du métabolisme, de la perfusion et de la charge en fer. Il convient à présent de mener des travaux sur l’intégration de ces marqueurs afin d’en exploiter les informations multimodales et complémentaires.
Le projet de l’équipe est de développer des mesures de connectivité cérébrale multimodale dans l’étude des mécanismes physiopathologiques des troubles cognitifs appliquées aux maladies neurologiques et leurs modèles animaux. Ces outils permettront un suivi personnalisé par des approches d’IA et seront basés sur l’intégration d’informations provenant de données médicales multimodales.
Composition de l'équipe: UMR-S 1172 : Renaud Lopes (PI), Grégory Kuchcinski (co-PI), Régis Bordet, Jean-Pierre Pruvo, Xavier Leclerc, Olivier Outteryck, Cécile Bordier, Frank Semah, Kathy Dujardin, Florence Pasquier, Charlotte Cordonnier, Luc Defebvre, David Devos, Caroline Moreau, Etienne Allart, Maxime Bertoux, Xavier Delbeuck, Nacim Betrouni, Thibaut Dondaine, Martin Bretzner (doctorant), Quentin Vannod-Michel (doctorant), Morgan Gautherot (doctorant), Vincent Roca (doctorant), Jean-Baptiste Davion (doctorant), Guillaume Carey (doctorant) ;
UMS2014 – US41 : Damien Huglo, Romain Viard, Florent Auger, Clémence Leboullenger
Faits marquants
1 - Etude en imagerie des troubles cognitifs post-AVC
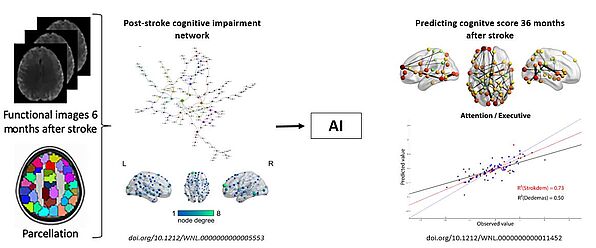
Depuis 2015, nous menons des travaux sur l’étude des troubles cognitifs post-AVC. Nous avons identifié un réseau fonctionnel altéré en IRM et spécifique aux atteintes cognitives. Ce réseau a ensuite été utilisé et couplé à un algorithme d’IA dans la prédiction personnalisée au long terme de ces atteintes, grâce à une collaboration avec les Prs. M. Dichgans et M. Duering de l’Institute for stroke and dementia research de Munich. 2 publications dans Neurology sont issues de ces travaux.
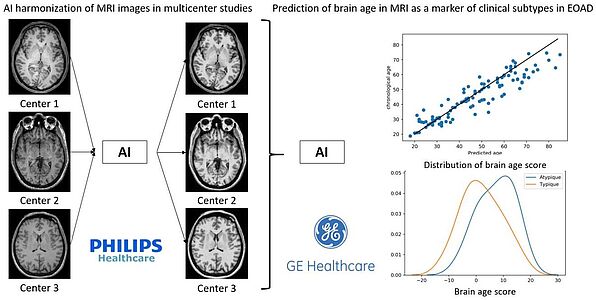
2 - Apport de l'Intelligence Artificielle en neurosciences
Depuis 2018, un partenariat scientifique avec General Electric est en place sur la prédiction d’âge cérébral en IRM, par deep learning, comme marqueur des formes de la maladie d’Alzheimer du sujet jeune (thèse de M. Gautherot). Depuis 2020, un partenariat avec Philips est en place sur l’harmonisation par IA des images IRM dans le cadre des études multicentriques (thèse de V. Roca). Par ailleurs, M. Bretzner (doctorant) réalise une mobilité au MGH à Boston sur l’utilisation de machine learning sur une cohorte de 2000 AVC ischémiques.
Publications
Lopes, R ; Bournonville, C ; Kuchcinski, G ; Dondaine, T ; Mendyk, A-M ; Viard, R ; Pruvo, J-P ; Hénon, H ; Geogarkis, M ;Duering, M ; Dichgans, M ; Cordonnier, C ; Leclerc, X ; Bordet, R ; Prediction of Long-term Cognitive Functions after Minor Stroke, Using Functional Connectivity, Neurology, 2021, early view. DOI: 1212/WNL.0000000000011452
Vanhoutte, M ; Semah, F ; Leclerc, X ; Sillaire, AR ; Jaillard, A ; Kuchcinski, G ; Pasquier, F ; Lopes, R, Three-year changes of cortical 18F-FDG in amnestic vs. non-amnestic sporadic early-onset Alzheimer's disease., Eur J Nucl Med Mol Imaging, 2020, 47, 304-318. DOI: 1007/s00259-019-04519-w
Kuchcinski, G.; Munsch, F.; Lopes, R.; Bigourdan, A.; Su, J.; Sagnier, S.; Renou, P.; Pruvo, J.; Rutt, B.; Dousset, V.; Sibon, I.; Tourdias, T. Thalamic Alterations Remote to Infarct Appear as Focal Iron Accumulation and Impact Clinical Outcome. Brain 2017, 140, 1932–1946. DOI: 1093/brain/awx114
Porteur David Devos
Description du projet
Innovations thérapeutiques :
DIVE : La maladie de Parkinson est caractérisée par une déplétion cérébrale en dopamine qui ne peut pas être administrée oralement. Nous restaurons le cycle circadien de la dopamine en administrant celle-ci au niveau intra-cérébro-ventriculaire avec une pompe intra-abdominale. La dopamine en anaérobie a démontré l’efficacité et la tolérance dans 3 modèles in vivo et transféré à la start-up InBrain Pharma permettant l’essai clinique de phase I-II montrant la tolérance et l’efficacité chez un premier des 20 patients.
GIFT : Une biothérapie de neuroprotection et de neurorestauration basée sur l’utilisation du puissant système physiologique de réparation contenu dans les plaquettes, modifié pour être compatible avec le système nerveux central. Après une validation préclinique, la préparation de l’essai clinique pour la sclérose latérale amyotrophique est en cours via le transfer à la startup InVenis Biotherapies. Une solution intranasale de nanoparticules est en cours de développement pour les maladies moins sévères.
Composition de l'équipe:
UMRS 1172: David Devos, Caroline Moreau, Jean Christophe Devedjian, Anne Sophie Rolland, Pauline Guyon, Charlotte Laloux, Flore Gouel, Kelly Timmerman, Cédrick Lachaud, Aurélie Jonneaux, Maud Petrault, Laura Mahoney-Sanchez, Hind Bouchaoui, Karim Belarbi, Marie Amandine Bonte, Emma Theerens, Florent Auger, Clemence Leboullenger, Renaud Lopes, Nacim Betrouni, Jean Pierre Pruvo, Gregory Kuchcinski, Romain Viard, Luc Defebvre, Véronique Danel, Dominique Deplanque, Régis Bordet
Laboratoire international : NeuroTMULille International Laboratory, Univ. Lille & Taipei Medical University, Lille (France) & Taipei (Taiwan) : Thierry Burnouf, Liling Delila, Ouada Nebie, Chou MingLi
Collaborations locales:
Pharm Inject, ULR 7375 GRITA : Pascal Odou, Natacha Carta, Christine Barthelemy
Pharmacie Centrale CHU de Lille: Pascal Odou, Damien Lannoy
Institut d'Electronique, de Microélectronique et de Nanotechnologie (IEMN), UMR CNRS8520 : Sabine Szunerits, Rabah Boukherroub, Alexandre Barras, Quentin Pagneux
UMRS1172: David Blum (équipe A&T)
ULR4483 - IMPact de l'Environnement Chimique sur la Santé (IMPECS) : Guillaume Garçon
GIMAP EA3064 & Établissement Français du Sang Auvergne-Rhône-Alpes : Fabrice COGNASSE
Startup (spin off de l’équipe de recherche):
InBrain Pharma https://www.inbrainpharma.com/ Matthieu Fisichella, Alexandre Demailly, Marine Rebier, Caroline Moreau, David Devos
InVenis Biotherapies (en création) : Matthieu Fisichella, Alexandre Demailly, Marine Rebier, Caroline Moreau, David Devos, Thierry Burnouf
Collaborations industrielles
Flowonix, Tricumed, et Renishaw
Labels/ financements
Satt-Nord, Cabri, Fondation Crédit Agricole, Fondation de l'Université, I-Site
Faits marquants
Le projet Dopamine IntraVEntriculaire (DIVE) pour traiter les fluctuations sévères de la maladie de Parkinson a conduit à un brevet académique transféré à la Startup InBrain Pharma, Spin off de notre unité de recherche, financée par Finovam, NFA et la fondation de l’université. InBrain pharma a également remporté 4 prix (Eurasanté, Fondation de l’Université de Lille, ILAB, DeepTech) et est déjà en phase clinique 1 et 2b avec un premier patient parkinsonien amélioré et sans problème de sécurité ! (Illustration 1)
Le projet de biothérapie utilisant des lysats plaquettaires modifiés (GIFT) a obtenu les prix de la prématuration I-SITE-ULNE et de la Fondation Crédit Agricole, a conduit à 3 brevets académiques transférés la Startup InVenis Biothérapie, Spin off de notre unité de recherche, qui va lancer l’essai thérapeutique de phase 1 et 2b dans la sclérose latérale amyotrophique. (Illustration 2)
Deux nouveaux projets académiques en phase préclinique poursuivent le développement de ce nouveau concept thérapeutique dont ACTIVE sur le modèle de DIVE avec l’obtention récente d’un financement régional (Stimule) et Nano-GIFT qui développe une formulation à base de nanoparticules pour une administration intranasale pour des maladies moins sévère du système nerveux central. (Illustration 3)
Publications
Seven Solutions for Neuroprotection in Parkinson's Disease.Devos D, Hirsch E, Wyse R. Mov Disord. 2020 Nov 13.
Intraventricular dopamine infusion alleviates motor symptoms in a primate model of Parkinson's disease. Moreau C, Rolland AS, Pioli E, Li Q, Odou P, Barthelemy C, Lannoy D, Demailly A, Carta N, Deramecourt V, Auger F, Kuchcinski G, Laloux C, Defebvre L, Bordet R, Duce J, Devedjian JC, Bezard E, Fisichella M, Devos D. Neurobiol Dis. 2020;139:104846.
The protective effect of human platelet lysate in models of neurodegenerative disease: involvement of the Akt and MEK pathways. Gouel F, Do Van B, Chou ML, Jonneaux A, Moreau C, Bordet R, Burnouf T, Devedjian JC, Devos D. J Tissue Eng Regen Med. 2017;11:3236-3240.
Porteur Jean-Christophe Devedjian
Description du projet
Les maladies neurodégénératives sont multifactorielles mais se caractérisent toutes par la mort régulée de neurones qui en fonction de leur localisation ont des expressions cliniques variables. Longtemps, le dogme d’une mort régulée unique par apoptose a limité la recherche. Parmi les autres formes, la ferroptose a été décrite récemment et se caractérise par une dépendance au fer et une accumulation de lipides peroxydés au niveau de la membrane entrainant sa rupture. Nous avons démontré in vitro et in vivo que les neurones dopaminergiques humains étaient particulièrement sensibles à la ferroptose et que des inhibiteurs spécifiques comme la Ferrostatin-1, la Liproxstatin-1 et des chélateurs de fer sont de puissants agents neuroprotecteurs.
A présent nous travaillons sur les liens avec l’alpha synucléine, le métabolisme lipidique et le métabolisme énergétique mitochondrial tout en développant des biomarqueurs spécifiques et des nouvelles molécules et de larges essais thérapeutiques.
Composition de l'équipe: Jean Christophe Devedjian, David Devos, Caroline Moreau, Anne Sophie Rolland, Pauline Guyon, Charlotte Laloux, Flore Gouel, Kelly Timmerman, Cédrick Lachaud, Aurélie Jonneaux, Maud Petrault, Laura Mahoney-Sanchez, Hind Bouchaoui, Karim Belarbi, Marie Amandine Bonte, Emma Theerens, Florent Auger, Clemence Leboullenger, Renaud Lopes, Nacim Betrouni, Jean Pierre Pruvo, Gregory Kuchcinski, Romain Viard, Véronique Danel Luc Defebvre, Dominique Deplanque, Régis Bordet
Collaborations lilloises:
UMRS 1172 Vincent Huin (équipe A&T), Patricia Melnyk, Séverine Ravez, Jamal El Bakali (équipe BBC)
ULR4483 - IMPact de l'Environnement Chimique sur la Santé (IMPECS) : Guillaume Garçon
UMR9020 – UMR-S 1277: Philippe Marchetti, Jérome Kluza
Collaborations internationales:
ALBORADA Drug Discovery Institute, University of Cambridge, UK: James Duce
Melbourne Dementia Research Centre, The Florey Institute of Neuroscience & Mental Health, The University of Melbourne, Australia: Ashley Bush, Scott Ayton
University of Munich Helmholtz Zentrum Muenchen Germany: Marcus Conrad
University of Ulm Germany: Markus Otto, Patrick Oeckl, Deniz Yilmazer-Hanke, Volker RascheA&M Della Pergola Chair in Life Sciences, Alexander Silberman Institute of Life Sciences, Hebrew University of Jerusalem, Israel 91904: Ioav Cabantchik
Consortium Européen FAIRPARK-II https://www.fairpark2.eu/
Collaborations industrielles avec contrats:
Chélateurs de fer : Apopharma/Chiesi, Alterity, Abfero
Antiferroptotiques : PTC Therapeutics
Labels/ financements:
- 3 PHRC-Nationaux dont FAIR-ALS-II Conservative Iron Chelation by Deferiprone as a Disease-modifying Strategy for Amyotrophic Lateral Sclerosis using a multicentre, Parallel-group, Placebo-controlled, Randomized Clinical Trial on 240 patients Protocol ID: 2017-003763-35; ClinicalTrials.gov: NCT03293069.
- Associations de patients (ARSLA, France Parkinson)
- European Commission Horizon 2020, grant agreement N° 633190 Conservative iron chelation as a disease-modifying strategy in Parkinson’s disease: a multicentre, parallel-group, placebo-controlled, randomized clinical trial of deferiprone (FAIR-PARK-II); Protocol ID: 2015_22; Clinical trial: NCT02655315
- European funds for preclinical research of excellence on neurodegenerative diseases: Network of Centres of Excellence in Neurodegeneration (CoEN) 2017-2018: Pathfinder III: Is prion like propagation of alpha synuclein aggregation associated with a ferroptotic cell death; PRION-IRON
- European Commission Horizon 2020 Eurostar for preclinical research: PD-IRONSYN, Novel Parkinson's Disease therapy targeting iron-related cell death and alpha synuclein aggregation
Faits marquants
3 subventions de la Commission européenne (H2020) dont 2 précliniques et 1 clinique
- Centres d'excellence en neurodégénération : Propagation prion like d’∝-synucléine et ferroptose
- Eurostar : Nouvelle thérapie ciblant la ferroptose et l'agrégation d’∝-synucléine
- Essai clinique : Neuroprotection par chélation conservatrice du fer dans le parkinson : essai clinique randomisé, multicentrique à groupes parallèles, deferiprone versus placebo https://www.fairpark2.eu/
Nouveaux biomarqueurs et nouveaux traitements : La surcharge en fer et la peroxydation lipidique massive offrent des nouveaux biomarqueurs par imagerie et par biologie qui permettent de mieux définir les populations ayant un processus ferroptotique et de suivre l’efficacité thérapeutique pour faciliter le développement de nouveaux chélateurs (Abfero, Alterity) ou encore la deferiprone dans la SLA (étude FAIRALS).
Découverte de médicaments: L’enrichissement en acide gras polyinsaturés sensibilise la ferroptose. L'inhibition d’enzymes impliquées dans le métabolisme lipidique (ACSL4 et LOX15) empêche la peroxydation des lipides et la mort cellulaire. La variation des niveaux d’∝-synucléine module la sensibilité à la ferroptose mais pas aux autres formes de mort cellulaire offrant de nouvelles cibles thérapeutiques (inhibiteurs de LOX15, PTC Therapeutics) et de nouvelle molécule (co-développement Lille et Cambridge).
Publications
Ferroptosis, a newly characterized form of cell death in Parkinson's disease that is regulated by PKC. Do Van B, Gouel F, Jonneaux A, Timmerman K, Gelé P, Pétrault M, Bastide M, Laloux C, Moreau C, Bordet R, Devos D, Devedjian JC. Neurobiol Dis. 2016 doi: 10.1016/j.nbd.2016.05.011.
Ferroptosis and its potential role in the physiopathology of Parkinson's Disease. Mahoney-Sanchez L, Bouchaoui H, Ayton S, Devos D, Duce JA, Devedjian JC. Prog Neurobiol. 2021 doi: 10.1016/j.pneurobio.2020.101890.
Iron as a therapeutic target for Parkinson's disease. Moreau C, Duce JA, Rascol O, Devedjian JC, Berg D, Dexter D, Cabantchik ZI, Bush AI, Devos D. Mov Disord. 2018 doi: 10.1002/mds.27275.
Porteur Arnaud Delval
Description du projet
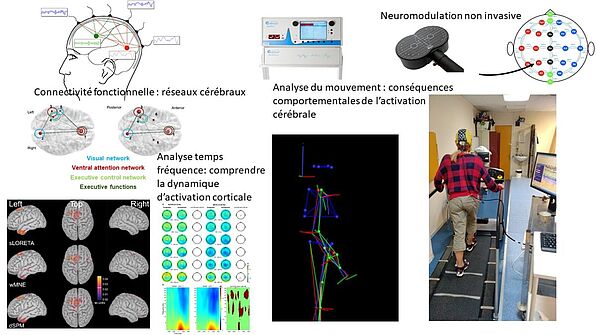
L’équipe projet neurophysiologie a pour but de développer et d’utiliser les outils neurophysiologiques (Electroencéphalogramme haute résolution, stimulation cérébrale non invasive, analyse du mouvement) nécessaires à la compréhension et à la prise en charge des maladies à expression neurologique. Des aspects plus fondamentaux visant à mieux comprendre le fonctionnement cérébral et à développer des marqueurs pertinents d’un processus physiopathologique sont également développés. L’équipe s’intéresse particulièrement au contrôle moteur et à ses interactions avec une atteinte cognitive que ce soit dans le vieillissement (impact sur les chutes) ou dans les pathologies des noyaux gris centraux (maladie de Parkinson), en post accident vasculaire cérébral, dans les démences, l’épilepsie ou dans les maladies neuro-musculaires. Une dernière approche concerne la médecine décisionnelle. Il s’agit d’exploiter les marqueurs physiologiques mis en évidence dans les études de cohortes pour faciliter leur utilisation en routine clinique. Les travaux se basent sur l’utilisation des approches d’apprentissage machine et de big data pour construire des modèles décisionnels allant au niveau individuel du patient et combinant de manière optimale les différents marqueurs.
Composition de l'équipe : Nacim Betrouni et Philippe Derambure
Faits marquants
- Développement de nombreuses collaborations ces dernières années
- au niveau du campus lillois (laboratoire Cristal, François Cabestaing, développement d’interfaces cerveau-machine, Scalab, Cedrick Bonnet, aspects posturographiques ; Ali Amad et Arnaud Leroy, neuromodulation et troubles comportementaux)
- au niveau régional (ULCO, Hervé Devanne : modulation de l’activité corticale, plasticité et conséquences sur le contrôle moteur)
- à un niveau national (université de Bordeaux, Pr Dominique Guehl, Pr Fabrice Wendling et Mahmoud Hassan (LTSI UMR Inserm Université de Rennes))
- à un niveau international (université de Kiel, Christian Schlenstedt, université de Nimègue, Bas Bloem, Claudio Babiloni (Department of Physiology and Pharmacology, Université de Sapienza, Italie)…
- Mise en place au cours des 3 dernières années des méthodes d’analyse de la connectivité fonctionnelle en EEG
- Développement de routines opérationnelles au sein de l’équipe permettant d’accueillir des étudiants peu formés au traitement du signal (analyse de source, potentiels évoqués, analyse temps-fréquence, connectivité)
- Plateau technique permettant une communication des outils (PC de stimulation permettant une administration d’épreuves cognitives, EEG Haute résolution, système d’analyse du mouvement, systèmes de neuromodulation…)
Publications
Allali G, Blumen H, Devanne H, Pirondini E, Delval A, Van De Ville D. Brain imaging of locomotion in neurological conditions. Neurophysiol Clin 2018;48:337–59. https://doi.org/10.1016/j.neucli.2018.10.004.
Allart E, Delval A, Caux-Dedeystere A, Labreuche J, Viard R, Lopes R, et al. Parietomotor connectivity in the contralesional hemisphere after stroke: A paired-pulse TMS study. Clin Neurophysiol 2017;128:707–15. https://doi.org/10.1016/j.clinph.2017.02.016.
Allart E, Devanne H, Delval A. Contribution of transcranial magnetic stimulation in assessing parietofrontal connectivity during gesture production in healthy individuals and brain-injured patients. Neurophysiol Clin 2019;49:115–23. https://doi.org/10.1016/j.neucli.2018.12.005.
Allart E, Viard R, Lopes R, Devanne H, Delval A. Influence of Motor Deficiency and Spatial Neglect on the Contralesional Posterior Parietal Cortex Functional and Structural Connectivity in Stroke Patients. Brain Topogr 2020;33:176–90. https://doi.org/10.1007/s10548-019-00749-1.
Barthel C, van Helvert M, Haan R, Janssen A, Delval A, de Vries N, et al. Visual cueing using laser shoes reduces freezing of gait in Parkinson’’s patients at home. Mov Disord 2018a;33:1664–5. https://doi.org/10.1002/mds.27455.
Barthel C, Nonnekes J, van Helvert M, Haan R, Janssen A, Delval A, et al. The laser shoes: A new ambulatory device to alleviate freezing of gait in Parkinson disease. Neurology 2018b;90:e164–71. https://doi.org/10.1212/WNL.0000000000004795.
Bayot M, Delval A, Moreau C, Defebvre L, Hansen C, Maetzler W, et al. Initial center of pressure position prior to anticipatory postural adjustments during gait initiation in people with Parkinson’’s disease with freezing of gait. Parkinsonism Relat Disord 2021;84:8–14. https://doi.org/10.1016/j.parkreldis.2021.01.012.
Bayot M, Dujardin K, Dissaux L, Tard C, Defebvre L, Bonnet C, et al. Can dual-task paradigms predict Falls better than single task? - A systematic literature review. Neurophysiol Clin 2020;50:401–40. https://doi.org/10.1016/j.neucli.2020.10.008.
Bayot M, Dujardin K, Tard C, Defebvre L, Bonnet C, Allart E, et al. The interaction between cognition and motor control: A theoretical framework for dual-task interference effects on posture, gait initiation, gait and turning. Neurophysiol Clin 2018;48:361–75. https://doi.org/10.1016/j.neucli.2018.10.003.
Besson P, Carrière N, Bandt S, Tommasi M, Leclerc X, Derambure P, et al. Whole-Brain High-Resolution Structural Connectome: Inter-Subject Validation and Application to the Anatomical Segmentation of the Striatum. Brain Topogr 2017;30:291–302. https://doi.org/10.1007/s10548-017-0548-0.
Betrouni N, Delval A, Chaton L, Defebvre L, Duits A, Moonen A, et al. Electroencephalography-based machine learning for cognitive profiling in Parkinson’’s disease: Preliminary results. Mov Disord 2019;34:210–7. https://doi.org/10.1002/mds.27528.
Bocquillon P, Charley-Monaca C, Houdayer E, Marques A, Kwiatkowski A, Derambure P, et al. Reduced afferent-induced facilitation of primary motor cortex excitability in restless legs syndrome. Sleep Med 2017;30:31–5. https://doi.org/10.1016/j.sleep.2016.03.007.
Bonnet C, Delval A, Singh T, Defebvre L. Parkinson’’s disease-related changes in the behavioural synergy between eye movements and postural movements. Eur J Neurosci 2021a;54:5161–72. https://doi.org/10.1111/ejn.15351.
Bonnet C, Delval A, Singh T, Kechabia Y, Defebvre L. New insight into Parkinson’’s disease-related impairment of the automatic control of upright stance. Eur J Neurosci 2020;52:4851–62. https://doi.org/10.1111/ejn.14870.
Bonnet C, Delval A, Szaffarczyk S, Defebvre L. Levodopa has primarily negative influences on postural control in patients with Parkinson’’s disease. Behav Brain Res 2017;331:67–75. https://doi.org/10.1016/j.bbr.2017.05.033.
Bonnet C, Dubrulle D, Barela J, Defebvre L, Delval A. Optimization of postural control in precise gaze shifts and laser pointing. Hum Mov Sci 2021b;79:102853. https://doi.org/10.1016/j.humov.2021.102853.
Braquet A, Bayot M, Tard C, Defebvre L, Derambure P, Dujardin K, et al. A new paradigm to study the influence of attentional load on cortical activity for motor preparation of step initiation. Exp Brain Res 2020;238:643–56. https://doi.org/10.1007/s00221-020-05739-5.
Caux-Dedeystère A, Allart E, Morel P, Kreisler A, Derambure P, Devanne H. Late cortical disinhibition in focal hand dystonia. Eur J Neurosci 2021;54:4712–20. https://doi.org/10.1111/ejn.15333.
Del Percio C, Derambure P, Noce G, Lizio R, Bartrés-Faz D, Blin O, et al. Sleep deprivation and Modafinil affect cortical sources of resting state electroencephalographic rhythms in healthy young adults. Clin Neurophysiol 2019;130:1488–98. https://doi.org/10.1016/j.clinph.2019.06.007.
Delval A, Bayot M, Defebvre L, Dujardin K. Cortical Oscillations during Gait: Wouldn’’t Walking be so Automatic? Brain Sci 2020;10. https://doi.org/10.3390/brainsci10020090.
Delval A, Bayot M, Lapoulvereyrie R, Defebvre L, Vermersch P, Tard C. Role of the peripheral nervous system for an appropriate postural preparation during gait initiation in patients with a chronic inflammatory demyelinating polyneuropathy: A pilot study. Gait Posture 2021a;90:29–35. https://doi.org/10.1016/j.gaitpost.2021.08.001.
Delval A, Betrouni N, Tard C, Devos D, Dujardin K, Defebvre L, et al. Do kinematic gait parameters help to discriminate between fallers and non-fallers with Parkinson’’s disease? Clin Neurophysiol 2021b;132:536–41. https://doi.org/10.1016/j.clinph.2020.11.027.
Delval A, Braquet A, Dirhoussi N, Bayot M, Derambure P, Defebvre L, et al. Motor Preparation of Step Initiation: Error-related Cortical Oscillations. Neuroscience 2018;393:12–23. https://doi.org/10.1016/j.neuroscience.2018.09.046.
Delval A, Defebvre L, Tard C. Freezing during tapping tasks in patients with advanced Parkinson’’s disease and freezing of gait. PLoS One 2017;12:e0181973. https://doi.org/10.1371/journal.pone.0181973.
Derambure P, Lefaucheur J. Clinical neurophysiology: The quest to understand motor and postural control. Neurophysiol Clin 2019;49:89–90. https://doi.org/10.1016/j.neucli.2019.03.003.
Hassan M, Chaton L, Benquet P, Delval A, Leroy C, Plomhause L, et al. Functional connectivity disruptions correlate with cognitive phenotypes in Parkinson’’s disease. Neuroimage Clin 2017;14:591–601. https://doi.org/10.1016/j.nicl.2017.03.002.
Lacan L, Betrouni N, Lamblin M, Chaton L, Delval A, Bourriez J, et al. Quantitative approach to early neonatal EEG visual analysis in hypoxic-ischemic encephalopathy severity: Bridging the gap between eyes and machine. Neurophysiol Clin 2021;51:121–31. https://doi.org/10.1016/j.neucli.2020.12.003.
Leroy A, Beigné M, Petyt G, Derambure P, Vaiva G, Amad A. Psychogenic non-epileptic seizures treated with guided transcranial direct current stimulation: A case report. Brain Stimul 2019;12:794–6. https://doi.org/10.1016/j.brs.2019.01.019.
Leroy C, Bourriez J, Dujardin K, Molaee-Ardekani B, Babiloni C, Deplanque D, et al. A 15-day course of donepezil modulates spectral EEG dynamics related to target auditory stimuli in young, healthy adult volunteers. Clin Neurophysiol 2019;130:863–75. https://doi.org/10.1016/j.clinph.2015.11.018.
Niguet J, Tortuyaux R, Garcia B, Jourdain M, Chaton L, Préau S, et al. Neurophysiological findings and their prognostic value in critical COVID-19 patients: An observational study. Clin Neurophysiol 2021;132:1009–17. https://doi.org/10.1016/j.clinph.2021.02.007.
Viseux F, Delval A, Defebvre L, Simoneau M. Postural instability in Parkinson’’s disease: Review and bottom-up rehabilitative approaches. Neurophysiol Clin 2020;50:479–87. https://doi.org/10.1016/j.neucli.2020.10.013.
Porteur Louise Carton
Porteur Maud Petrault
Contexte médical et scientifique
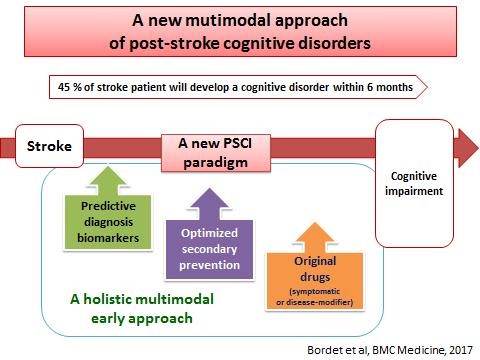
La survenue de troubles cognitifs au décours d’un accident vasculaire cerebral ischémique est maintenant bien connue. L’objectif du projet est d’identifier des facteurs prédictifs de survenue de ces troubles cognitifs, y compris pour des accidents vasculaires peu sévères, et de caractériser des approches pharmacologiques susceptibles de prévenir, d’améliorer ou de ralentir l’évolution de ces troubles pharmacologiques. Ce projet est mené par une approche translationnelle, combinant des modèles animaux, des études de cohortes et des études interventionnelles. Les outils méthodologiques combinent des marqueurs biologiques, des échelles neuropsychologiques et de l’imagerie cérébrale.
Composition de l'équipe: Régis Bordet, Charlotte Cordonnier, Didier Leys, Dominique Deplanque, Hilde Hénon, Stéphanie Bombois, Thibaut Dondaine, Renault Lopes, Xavier Leclerc, Nacim Betrouni, Michèle Bastide, Maud Petrault, Thavarak Ouk, Cécile Bordier, Patrick Duriez, Christine Delmaire, Jean-Pierre Pruvo, Charlotte Laloux, Grégory Kuchcinski, Patrick Gelé
Collaborations internationales: M Dichgans (Munich), Consortium Strokog (Australie), Consortium VCI Map PSCI (Utrecht) Strokavenir network
Collaborations industrielles: Theranexus, Metabrain Research, Qynapse, Axoltis, Kowa
Labels/ financements: PHRC, FUI, Financement Industriel, Conseil Régional
Faits marquants
- En collaboration avec l’équipe de Martin Dichgans (Munich), nous avons pu montrer que des accidents vasculaires cérébraux, sans conséquences motrices majeures, s’accompagnaient dans 45% des cas de la survenue d’un trouble cognitif à 6 mois
- En combinant un modèle animal et une étude de cohorte, nous avons montré qu’à 6 mois, la survenue d’un trouble cognitif était associée à une atrophie du cortex entorhinal et d’une déformation de l’hippocampe
- Nous avons identifié un circuit de connectivité qui est altéré chez les patients présentant un trouble cognitif post-AVC, et le caractère évolutif de cette altération à 3 ans.
- Nous avons identifié que l’analyse de texture de l’hippocampe, mesurée en IRM à 72h après la survenue de l’accident vasculaire cérébral, peut permettre de prédire le développement d’un trouble cognitif post-AVC
- La cohorte STROKDEM, qui regroupe 200 patients suivis à 5 ans, est une cohorte constitutive de plusieurs consortia internationaux (Strokog, MICON, VCI map PSCI)
- Un des objectifs de l’étude CEOPS est d’étudier si l’optimisation de la prévention secondaire des accidents vasculaires cérébraux a un impact sur le développement des troubles cognitifs.
Publications
Lopes R, Bournonville C, Kuchcinski G, Dondaine T, Mendyk AM, Viard R & al , Prediction of Long-term Cognitive Functions after Minor Stroke, Using Functional Connectivity., Neurology, 2021
Betrouni N, Yasmina M, Bombois S, Pétrault M, Dondaine T, Lachaud C & al , Texture Features of Magnetic Resonance Images: an Early Marker of Post-stroke Cognitive Impairment., Transl Stroke Res, 2019
Zietemann V, Georgakis MK, Dondaine T, Müller C, Mendyk AM, Kopczak A & al , Early MoCA predicts long-term cognitive and functional outcome and mortality after stroke., Neurology, 2018Bournonville C, Hénon H, Dondaine T, Delmaire C, Bombois S, Mendyk AM & al , Identification of a specific functional network altered in poststroke cognitive impairment., Neurology, 2018
Mendyk AM, Duhamel A, Bejot Y, Leys D, Derex L, Dereeper O & al , Controlled Education of patients after Stroke (CEOPS)-nurse-led multimodal and long-term interventional program involving a patient''s caregiver to optimize secondary prevention of stroke: study protocol for a randomized controlled trial, Trials, 2018
Delattre C, Bournonville C, Auger F, Lopes R, Delmaire C, Henon H & al , Hippocampal Deformations and Entorhinal Cortex Atrophy as an Anatomical Signature of Long-Term Cognitive Impairment: from the MCAO Rat Model to the Stroke Patient., Transl Stroke Res, 2017
Bordet R, Ihl R, Korczyn AD, Lanza G, Jansa J, Hoerr R & al , Towards the concept of disease-modifier in post-stroke or vascular cognitive impairment: a consensus report, BMC Med., 2017
Porteur Anne-Sophie Rolland
Description du projet
Après des décennies de recherche, les maladies neurodégénératives telles que la maladie de Parkinson (MP) et la sclérose latérale amyotrophique (SLA) ne bénéficient toujours pas de traitement neuroprotecteur. Ceci repose, au moins en partie, sur le manque de biomarqueurs fiables et sensibles de la gravité et de la progression de la maladie. Par conséquent, pour développer de nouvelles approches thérapeutiques visant à ralentir ou arrêter la progression de la maladie, il existe un besoin non satisfait i) d'identifier des biomarqueurs pronostiques pour prédire la progression et stratifier les patients pour des soins plus adaptés et de meilleure qualité et ii) d'identifier des biomarqueurs théragnostiques pour prédire l'efficacité. d'un traitement donné. En raison de la diversité des étiologies et des multiples voies physiopathologiques impliquées dans les maladies neurodégénératives, il est crucial d’effectuer une analyse fiable des biomarqueurs multiparamétriques (cliniques, biofluidiques, imagerie et génétique) pour prédire avec précision la progression de la maladie. Ce projet vise donc à i) découvrir des biomarqueurs innovants sur la MP et la SLA à l'aide de modèles animaux fiables ; et ii) traduire leur pertinence sur les cohortes de patients atteints de MP et de SLA. À cette fin, nous analyserons divers marqueurs biologiques tels que les miARN, réaliserons une protéomique impartiale et obtiendrons des informations sur les vésicules extracellulaires isolées des fluides pour développer des algorithmes mathématiques et une intelligence artificielle afin de fournir une analyse multiparamétrique et des modèles prédictifs.
Partenariat : ce projet rassemblera des équipes de recherche transdisciplinaires et transversales
- Centre Lil’N’Cog : équipe Pr Devos, équipe Dr Blum
- Université de Lille : Département de Mathématiques dirigé par le Dr Broustet, laboratoire IMPECS dirigé par le Dr LoGuidice
- Plateforme LIIFE à Lille : installations d'imagerie du petit animal et humaine
- Plateforme de protéomique clinique à Montpellier dirigée par le Pr Hirtz
- Brain Institute : équipe Aramis Dr Durrleman
- Biomolécules Institut Max Mousseron (Université de Montpellier) : équipe Dr Durand
Faits marquants
- La combinaison de biomarqueurs ferroptotiques biologiques et génétiques peut prédire la gravité, la progression et l’issue de la maladie de Parkinson. Article en préparation
- La consommation régulière de caféine n’a aucun effet néfaste sur le phénotype et la survie des patients atteints de SLA, mais les patients présentant une variante rare du SNP du CYP1A1 qui a un impact sur la métabolisation de la caféine ont un impact positif sur l’effet cognitif de la caféine sur les troubles cognitifs. Article en préparation
- L’utilisation de l’analyse des données topologiques sur l’IRM de diffusion pourrait prédire la progression de la maladie de Parkinson. Résultats préliminaires
Récompenses
- Fonds Hospitalier du CHU de Lille (2019) : 30 k€
- Association France Parkinson (2021) : 60 k€
- Thème PEPS AMIES (co-lauréat, 2023) : 7 k€
Porteur Nacim Betrouni
Description du projet
Dans les maladies neurodégénératives, l’imagerie jouent un rôle important pour la prise de décisions. Les marqueurs classiques se basent sur la quantification des modifications structurelles. Le projet NeuroRadioMics fait l’hypothèse que la mesure des variations du signal, par différentes statistiques, permet de mettre en évidence des modifications qui seraient précoces au changement morphologique. Cette hypothèse a été testée dans différentes conditions avec les cohortes de patients, développées par les collègues. Ainsi, la méthode s’est avérée efficace pour mettre en évidence un déclin cognitif post-AVC. De plus, une étude utilisant un modèle préclinique de l’AVC avait permis de montrer que ces mesures sont le reflet des modifications tissulaires. Dans la maladie de Parkinson, ces marqueurs se sont révélés corrélés aux troubles moteurs ou cognitifs
Nous travaillons actuellement à une meilleure compréhension de ces marqueurs grâce à des études de corrélations anatomo-pathologiques.
Composition de l'équipe : Nacim Betrouni, Chirine El Katrib
Collaborateurs : Charlotte Laloux, Régis Bordet, David Devos, Kathy Dujardin, Luc Defebvre, Caroline Moreau, Thibaut Dondaine, Anne-Sophie Rolland, Florent Auger, Maud Petrault, Grégory Kuchcinski, Jean-Pierre Pruvo, Renaud Lopes, Romain Viard
Faits marquants
- Dépôt de brevet sur le concept de radio-biopsie : la biopsie virtuelle dans les maladies dégénératives (WO2019170711A1PROCÉDÉ DE PRÉDICTION PRÉCOCE D'UN DÉCLIN NEURODÉGÉNÉRATIF), 2019
- Soutien par l’université de Lille à travers la Bonus Qualité Innovation pour le développement d’une preuve de concept pour le projet. 2020-2021.
- Mise en place d’une étudie multicentrique internationale, grâce au soutien du consortium STROKOG, pour tester la méthode dans la détection précoce des troubles cognitifs post-AVC. 2021.
Publications
Betrouni N, Moreau C, Rolland AS, Carrière N, Chupin M, Kuchcinski G, Lopes R, Viard R, Defebvre L, Devos D. Texture-based markers from structural imaging correlate with motor handicap in Parkinson's disease. Sci Rep. 2021 Feb 1;11(1):2724. doi: 10.1038/s41598-021-81209-4.
Betrouni N, Lopes R, Defebvre L, Leentjens AFG, Dujardin K. Texture features of magnetic resonance images: A marker of slight cognitive deficits in Parkinson's disease. Mov Disord. 2020 Mar;35(3):486-494. doi: 10.1002/mds.27931.
Betrouni N, Yasmina M, Bombois S, Pétrault M, Dondaine T, Lachaud C, Laloux C, Mendyk AM, Henon H, Bordet R. Texture Features of Magnetic Resonance Images: an Early Marker of Post-stroke Cognitive Impairment. Transl Stroke Res. 2020 Aug;11(4):643-652. doi: 10.1007/s12975-019-00746-3.
Porteur Vincent Berezowski
Description du projet
L’entrée massive de sang dans le cerveau peut être un événement mortel pour les personnes de tout âge. Aucun traitement spécifique n’existe à ce jour. Et les survivants subissent un déclin de leurs fonctions cognitives. Même les hémorragies microscopiques, lorsqu’elles sont plusieurs, n’apparaissent plus comme des lésions sans gravité pour le sujet âgé. Ce projet réunit neurologues et scientifiques pour comprendre les conséquences tissulaires et fonctionnelles des hémorragies cérébrales, macroscopiques comme microscopiques, et évaluer l’influence des facteurs de risque vasculaire et des traitements anticoagulants. Le choix a été fait d’une approche translationnelle alliant études cliniques, neuropathologiques, mais aussi l’imagerie et des modèles expérimentaux innovants.
Composition de l'équipe : Maud PETRAULT, Laurent PUY, Manon HAAS, Giuseppe SCOPELLITI, Antoine RAUCH, Olivier PETRAULT, Barbara CASOLLA, Marco PASI, Patrick GELE, François CAPARROS, Thavarak OUK, Michèle BASTIDE, Charlotte CORDONNIER, Vincent BEREZOWSKI.
Faits marquant
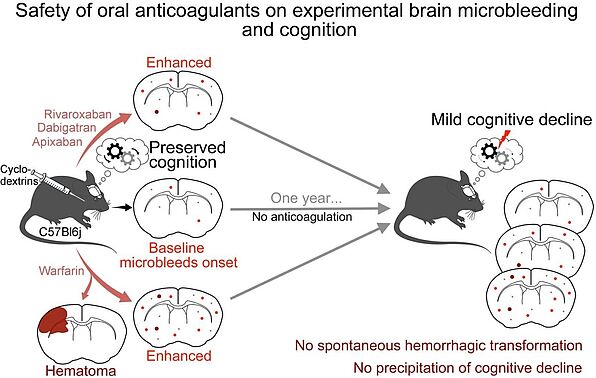
- Les microhémorragies ont un effet délétère propre sur la cognition même chez la souris saine à l’âge moyen, mais cet effet n’est pas aggravé par les anticoagulants oraux directs ou l’hypercholestérolémie.
- Chez l’homme, les NETs (neutrophil extracellular traps) interagissent avec l’hémostase dans l’hématome intracérébral (ICH), et une nouvelle histoire naturelle de la neuroinflammation dans la zone périhématome (PHA), ouvrant des cibles thérapeutiques potentielles (vert).
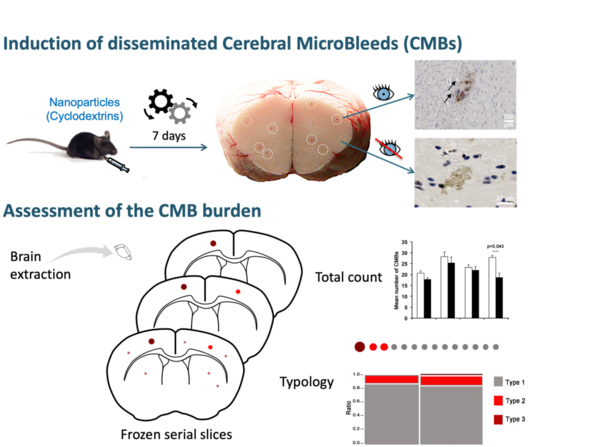
- Mise au point d’un modèle unique de microhémorragies cérébrales disséminées induites par des nanoparticules chez la souris.
Publications
Brain Peri-Hematomal Area, a Strategic Interface for Blood Clearance: A Human Neuropathological and Transcriptomic Study. Puy L, Perbet R, Figeac M, Duchêne B, Deramecourt V, Cordonnier C, Bérézowski V. Stroke. doi: 10.1161/STROKEAHA.121.037751. Epub ahead of print. PMID: 35465695, 2022.
Neutrophil Extracellular Traps (NETs) infiltrate hematoma and surrounding brain tissue after intracerebral hemorrhage: a post-mortem study. Puy L, Corseaux D, Perbet R, Deramecourt V, Cordonnier C, Bérézowski V. Neuropathol Appl Neurobiol. 47:867-877, 2021.
Age and diet modify acute microhemorrhage outcome in the mouse brain. Pétrault M, Ouk T, Bastide M, Bordet R, Pétrault O, Bérézowski V. Neurobiol Aging 98 :99-107, 2021.
Safety of oral anticoagulants on experimental brain microbleeding and cognition. Pétrault M, Ouk T, Pétrault O, Bastide M, Bordet R, Bérézowski V. Neuropharmacology. 155:162-172, 2019.
Cerebral microbleeds: Beyond the macroscope. Pétrault M, Casolla B, Ouk T, Cordonnier C, Bérézowski V. Int J Stroke. 14:468-475, 2019.
Porteur Lennart Mars
Notre domaine d’intérêt concerne les maladies inflammatoires du cerveau et de la moelle épinière qui peuvent être particulièrement néfastes en raison de la faible capacité de régénération du système nerveux central (SNC). Spécialisé dans la sclérose en plaques (SEP) et le trouble du spectre de la neuromyélite (NMOSD), le périmètre de notre laboratoire comprend des soins innovants aux patients via des essais cliniques et des recherches sur les biomarqueurs, ainsi que des recherches fondamentales visant à élucider la physiopathologie de la démyélinisation auto-immune.
Notre recherche translationnelle traite de l’impact de l’immuno-sénescence, des cellules B, de la microglie et des modifications post-traductionnelles en tant que nouveaux médiateurs de la neuroinflammation. Nous contribuons activement aux essais cliniques ciblant ces nouveaux signaux thérapeutiques afin de faire progresser la gestion clinique de la SEP.
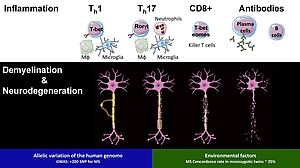
Le système nerveux central (SNC) est classiquement considéré comme un environnement immunitaire privilégié dans lequel les immunogènes peuvent persister dans le parenchyme sans provoquer de réponse immunitaire adaptative. Malgré cette caractéristique, le SNC n'est pas immunodéprimé, car les réponses inflammatoires locales attaquent les infections microbiennes et s'atténuent après l'élimination des agents pathogènes. Cela indique que le SNC peut contrôler intrinsèquement l'activité immunitaire et peut se mobiliser contre les lésions tissulaires à médiation immunitaire collatérales.
Nous étudions la dérégulation de ces interactions neuro-immunes dans le contexte de la sclérose en plaques et de la maladie de Devics avec les trois objectifs suivants:
Anticorps et Fc-glycosylation dans la neuroinflammation auto-immune.
La maladie de Devic est une maladie inflammatoire étiologiquement hétérogène qui affecte le nerf optique et la moelle épinière. Contrairement à la sclérose en plaques, une réponse d'autoanticorps neurale focalisée est essentielle pour provoquer la disparition pathogène des cellules gliales et des neurones du SNC. La spécificité de la réponse humorale a permis d'identifier 2 sous-ensembles avec une physiopathologie distincte. Anticorps dirigés contre l'aquaporine-4 (AQP-4); une protéine du canal de l'eau exprimée à la surface cellulaire des astrocytes du SNC sous-tend les troubles du spectre de Neuromyelitis optica. La démyélinisation progresse à partir d'une astropathie auto-immune qui peut être traitée par neutralisation de la réponse humorale en éliminant les lymphocytes B, ou en neutralisant le complément ou l'IL-6. Un deuxième sous-ensemble est caractérisé par des anticorps ciblant la glycoprotéine oligodendrocyte de myéline (MOG), un composant mineur de la myéline du SNC synthétisée par les oligodendrocytes. Cliniquement, MOGAD se manifeste par une névrite optique, mais peut impliquer une myélite ou, chez les enfants, une encéphalomyélite aiguë disséminée (ADEM) et une encéphalite auto-immune.
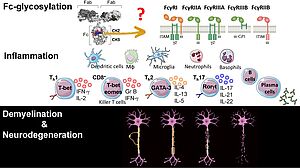
Les anticorps (Abs) exercent leur fonction en se liant à des récepteurs Fc distincts et au complément. L'affinité de ces interactions est traditionnellement attribuée à l'isotype Ab. Au moins pour les IgG, ce point de vue évolue. Les glycanes N-liés sont de plus en plus proposés pour influencer la liaison aux récepteurs Fc-gamma classiques (FcyR) et permettre la liaison à des récepteurs de type II non classiques. L'impact de cette nouvelle fonctionnalité Fc sur la réponse humorale dans les maladies inflammatoires du système nerveux central n'est pas connu. Nous définissons ces nouveaux traits de la réponse humorale pour la SEP, le NMOSD et le MOGAD à l'aide de diverses approches translationnelles.
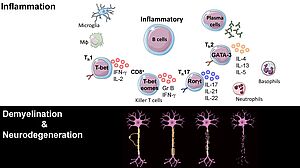
Pathogénicité indépendante des anticorps des cellules B
Sans aucun doute une maladie auto-immune, la SEP mobilise le plein souffle de la réponse immunitaire innée et adaptative. La maladie récurrente-rémittente est provoquée par une infiltration récurrente de cellules immunitaires provoquant des lésions démyélinisantes focales et des cicatrices axonales. Une neurodégénérescence plus prononcée s'ensuit dans la SEP progressive au cours de laquelle la réponse inflammatoire se structure dans le système nerveux central. Cette réponse immunitaire compartimentée du SNC persiste sans vagues d'infiltration immunitaire en présence d'une barrière hémato-encéphalique intacte. La neuroinflammation dans le parenchyme est complétée par l'apparition de follicules lymphoïdes ectopiques (ELF) dans les méninges qui entraînent la démyélinisation corticale et la disparition neuronale. Cette complexité de la réponse inflammatoire dans la SEP va au-delà de l'autoréactivité, impliquant une dérégulation immunitaire causée par une prédisposition génétique, une immuno-sénescence progressive et le vieillissement, et aux derniers stades une neurodégénérescence immunitaire indépendante. Nous travaillons sur un nouveau sous-ensemble de cellules B qui se développe chez les personnes âgées (> 65 ans) et contribue à la sénescence immunitaire CD8.